I. 서론
II. 임플란트 주위 질환의 원인 요소
1. 임플란트 주위 질환의 위험 지표
III. 치주질환, 임플란트 주위 질환과 미생물
IV. 미생물학적 접근 방법으로 연구된 지식
V. 고찰 및 결론
I. 서론
치과 임플란트 주위의 연조직, 경조직의 파괴적 염증성 질환을 의미하는 임플란트 주위 질환(peri-implant disease)은 현재 매우 보편화 되어 있는 임플란트 치료의 생물학적 합병증의 하나로써 최근 들어 그 발생 빈도 및 연구의 관심도가 급속히 증가하고 있는 질환 중 하나이다. 병변이 연조직에 국한 된 임플란트 주위 점막염(peri-implant mucositis)과 임플란트 주위 골조직에까지 연장된 임플란트 주위염(peri-implantitis)으로 크게 나누어지며, 전자는 연조직의 부종, 발적, 탐침시 출혈(bleeding on probing; BOP)을 보이는 가역적 염증인 반면, 후자는 점진적 골 흡수, 치주낭, 부종 및 농 형성의 동반이 가능한 비가역적 질환이다1.
임플란트 주위 점막염의 유병률은 임플란트 가운데 50%, 임플란트 치료를 받은 환자 가운데 80%로 보고되었고, 임플란트 주위염의 유병률은 연구의 이질성으로 인하여 다소 그 기복은 있으나, 임플란트를 기반으로 한 분석에서 12%~43%, 임플란트 치료를 받은 환자를 기반으로 한 분석에서 28~56% 이상으로 조사되었다1. 최근 47개의 논문으로부터 분석된 한 체계적 문헌고찰에서 임플란트 주위 질환의 유병률은 임플란트 기반으로 9.25 % (95% CI: [7.57, 10.93]), 환자 기반으로 19.83% (95% CI [15.38, 24.27])로 보고되었다2.
임플란트 주위염의 기여요소들을 살펴보면 보철적, 기계적 영향을 포함한 생역학적 요인(biomechanical factors), 미생물학적 요인, 압축력에 의한 괴사, 과열, 과삭제 등 수술로 인한 외상을 포함하는 생물학적 요인(biological factors) 등 여러 인자들이 존재하나, 이번 논문에서는 미생물학적 요인에 중점을 두고 기술하고자 한다. 임플란트 주위염은 미생물학적 관점에서 보았을 때 위험 요소나 원인 인자, 질환 관련 병원균의 분포, 병변의 개시 및 진행 양상이 치주염과 밀접한 연관성 및 상당한 공통점을 지니고 있다. 그러나, 최근 군유전체학(metagenomics)과 같은 새로운 기술을 도입한 몇 연구들에 의하면, 임플란트 주위조직의 미생물 분포가 치주조직과는 차이를 보이기도 하는 것으로 보고되고 있다. 이 논문의 목적은 임플란트 주위염의 원인 요소들을 살펴보고, 현재까지 알려진 임플란트 주위염과 연관된 미생물학적 지식들을 공유함으로써 임플란트 주위 질환의 예방 및 진단, 치료에 있어서 임상가들에게 도움을 주고자 함이다.
II. 임플란트 주위 질환의 원인 요소
1. 임플란트 주위 질환의 위험 지표
비가역적인 병변으로 여겨지는 임플란트 주위 골 소실의 원인은 크게 다음 세 가지로 분류된다. 불량한 식립 위치, 교합 과부하 또는 교합 간섭을 포함하는 생역학적 요인, 미생물학적 원인, 압축력에 의한 괴사, 과열, 과삭제 등 수술로 인한 외상을 포함하는 생물학적 요인 그리고 이 두 요인들의 혼합 요인으로 대별될 수 있다3. 이처럼 원인들의 특성으로 구분을 한 요인 분석 이외에도, 임플란트 주위 질환의 발생 및 진행과의 연관성이 입증된 다양한 지표들이 존재하고 있다. 지표들을 살펴보기에 앞서 용어의 차이들을 먼저 숙지해 둘 필요가 있다. 위험 인자(risk factor)란 대조군을 포함한 잘 디자인된 전향적 연구(prospective study)로 입증된 요소들을 나타내며, 위험 지표(risk indicator)는 후향적 연구(retrospective study)나 횡단연구(cross-sectional study)로 밝혀진 위험 관련 요소들을 일컫는다. 현재까지 이루어져 있는 임플란트 주위 질환 관련의 대부분의 연구는 진정한 위험 인자라기 보다는 위험 지표에 해당하는 것들로 볼 수 있다.
Heitz-Mayfield는 체계적 문헌 고찰을 통하여 임플란트 주위염의 위험 지표로 여겨지는 충분한 증거를 보이는 인자로서 불량한 구강위생, 과거 치주염 병력, 흡연을 제시하였다4. 치주치료가 이루어졌더라도 과거 치주염 병력이 있었던 환자, 치아 상실의 원인이 치주염과 연관된 경우 임플란트 주위염의 위험도가 높아진다고 제안하였다5,6. 치태 존재 부위와 BOP 존재 부위가 전체의 30%를 초과하는 불량한 구강 위생과도 그 연관성이 매우 높았으며, 흡연 상태와 불량한 구강 위생이 동반된다면 그 위험도가 현저히 높아지는 것으로 분석되었다7,8. 다음으로 제한적이지만 그 증거가 입증된 인자로서 당뇨와 음주를 제시하였다. 당뇨는 창상 치유 지연 및 감염에의 취약성으로 체내 많은 합병증을 야기할 수 있는 질환으로 임플란트 주위염의 위험도 또한 증가시키는 것으로 알려져 있다9,10. 185명의 환자를 대상으로 한 전향적 연구에서 이루어진 다변량 분석으로부터 흡연, 음주 및 불량한 구강 위생이 임플란트 주위 골 소실과 연관되어 있는 것으로 밝혀졌으나11, 음주와 임플란트 주위염 사이의 직접적 관계는 아직 많은 문헌으로 뒷받침 되지는 못한 상태이다. 마지막으로 다소 논란적이나 제한적인 증거를 지니고 있는 인자로서 유전적인 성향, 임플란트의 표면 성질을 제시하였다. Interleukin (IL)-1 유전자 다형성(gene polymorphism)이 임플란트 주위 골 소실과 밀접한 연관이 있고, 이러한 유전 성향이 과도한 흡연과 공동으로 작용하면 그 위험도가 가중된다는 연구가 있다12,13. 현재 시중에 통용되는 임플란트들은 대부분 그 표면이 중등도 거친 표면(moderately rough surface)으로 분류되는 제품들로, 거친 표면(rough surface)의 임플란트에서 변연골 소실이 더 많이 보고 되었다는 연구와 함께14, 과거에 많이 사용되었던 절삭 표면(turned surface)과 중등도 거친 표면 사이에는 변연골 흡수량의 차이가 없었다는 전향적 연구도 존재한다15.
III. 치주질환, 임플란트 주위 질환과 미생물
임플란트 주위 질환의 발생에 있어서 미생물학적 요인은 앞서 언급한 원인 요소들(etiologic factors) 가운데 생물학적 요인에 속하며, 병발의 주된 원인 중 하나로 여겨지고 있다. 임플란트 주위염에 미생물이 미치는 영향을 이해하기 위해서는 치주염의 발병에 미생물이 관여하는 기전을 충분히 이해하는 것이 먼저 필요하다. 치아 표면과 임플란트 표면은 세균침착을 허용하는 탈락하지 않는 단단한 표면(non-shedding, hard surface)이 존재하며, 외부 환경과 신체 내부 사이 상피와 결합조직의 특수한 밀봉이 존재한다는 점에서 매우 유사한 조건을 지니고 있다. 미생물이 이러한 치아나 임플란트 표면에 부착하는 과정을 알기 위하여, 먼저 바이오필름(biofilm)에 관하여 살펴보도록 하겠다. 바이오필름은 다당류, 단백질, 핵산과 같은 세포외 중합체(extracellular polymeric substance)의 기질 내에 둘러싸인 미생물로 이루어진 것으로, 세균의 미세 집락을 함유하고 있다. 치면 세균막인 치태는 바이오필름의 좋은 예이며, 치은열구액 같은 용액 속에서 부유하는 세균(planktonic bacteria)과 다른 기전으로 바이오필름의 기질은 방벽 작용을 할 수 있으므로, 세균 산물이 기질 내에 축적될 수 있어서 다른 세균과의 대사를 더 활발히 이루어지게 할 수 있다. 치은 연하 혹은 임플란트 점막 연하에 존재하는 바이오필름 내 미생물이 항원과 독소로 숙주의 조직을 향해 공격을 가해오면, 숙주는 면역-염증 반응을 활성화 시켜 항체의 생성, 백혈구 제시 등으로 대응하게 된다. 즉 미생물은 조직 손상에 직접적으로 기여하는 많은 대사 노폐물을 생성해 내는 동시에, 숙주의 싸이토카인(cytokines) 분비에도 영향을 주어 염증성 매개물질의 분비를 촉진하고, 염증반응을 더욱 강화시키게 된다. 미생물은 단백분해효소(proteases)와 같은 치주조직 혹은 임플란트 주위 조직을 파괴할 수 있는 효소도 생성함으로써 미생물의 영양에 필요한 펩타이드를 공급함과 동시에 숙주의 조직을 파괴하게 된다. 여기에 앞서 언급하였던 유전적 위험요소와 흡연, 당뇨 등 환경 및 후천적 위험요소가 결부되면 그렇지 않은 경우보다 질환의 개시 및 진행이 더 가속화 될 수 있다(Fig. 1)16.
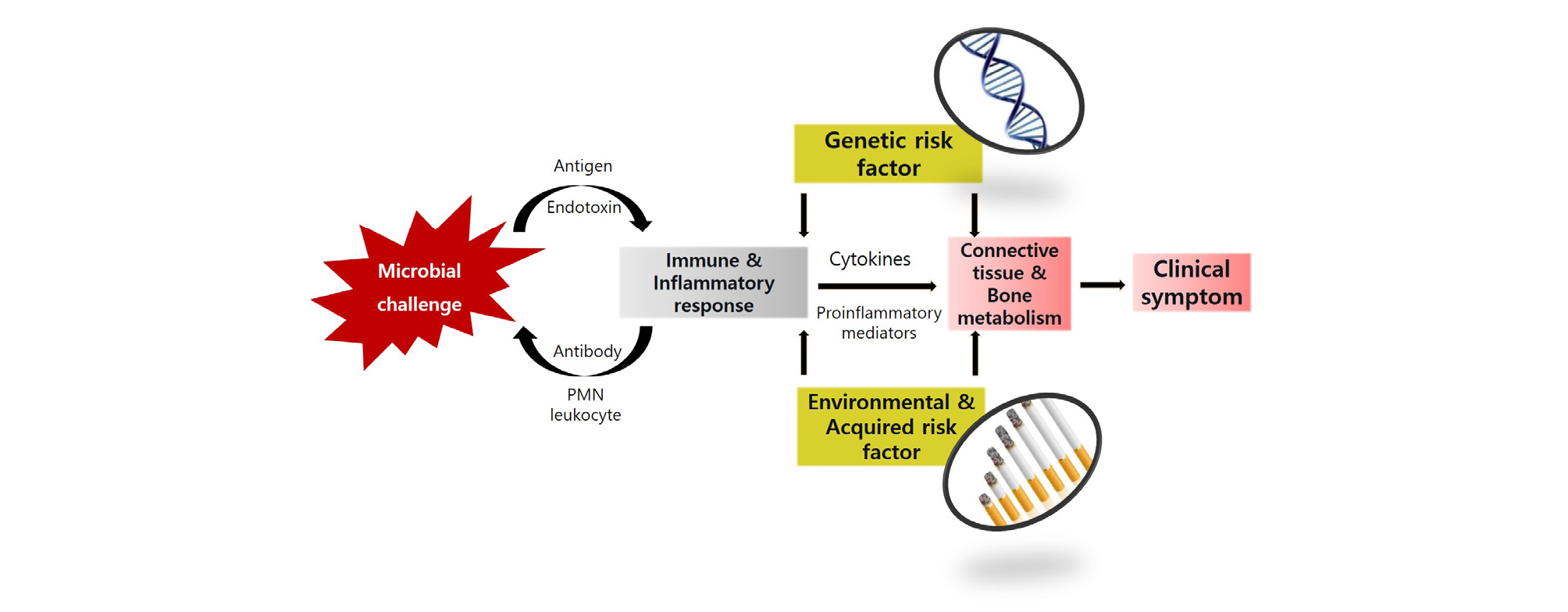
Fig. 1.
A mechanism showing how microorganisms are involved in the development of periodontitis or peri-implantitis. When microorganisms attack the host with their antigens and endotoxins, the host responds with a patient-specific immune-inflammatory response through the presentation of antibodies and polymorphonuclear(PMN) leukocytes. Proinflammatory mediators and cytokines released by the patient's response are combined with the genetic risk factors and environmental/ acquired risk factors for periodontitis or peri-implantitis, which affect the connective tissue and bone metabolism of the patient leading to clinical symptom.
Hyun Ju Kim et al. : Peri-implant disease: Etiological factors and microbiological approaches. Implantology 2018
IV. 미생물학적 접근 방법으로 연구된 지식
임플란트 주위 질환을 연구하기 위하여, 주된 원인 요소 중 하나인 미생물을 탐지해 내기 위한 연구는 치주질환에 관한 미생물학적 연구의 연장선상에서 활발히 이루어져 왔다. 이는 질환과 연관된 미생물을 탐지해 내거나, 치료 후 경과 관찰을 시행하는 과정에서 그 미생물 군집의 농도를 지속적으로 관찰함으로써 치주질환 혹은 임플란트 주위 질환의 예방, 진단 및 치료에 접목시키고자 하는 노력의 일환이었다. 이러한 미생물학적 접근 방법 가운데, 가장 전통적 골드 스탠다드로 여겨지는 방법으로 한천 고체배지에서 미생물을 배양하는 방법이 있다. 그러나 이 기법은 시간이 많이 소요되고, 배양이 어려운 균종이 존재하며, 성장에 필요한 성분이 이미 연구된 균종만 확인 가능하므로 실질적으로는 한계점이 있었다. 배양 기반의 방법 이외에도 미생물의 항원과 숙주의 면역 체계에 의해 생성된 항체의 상호작용을 이용하는 면역학적 방법, 미생물의 유전적 성분을 조사하고 탐지하는 유전형적 방법 등이 연구에 이용되고 있다.
1998년 Socransky 등은 185명의 대상으로부터 13261개 치은연하 치태 표본을 추출하여 각 표본에서 치은연하 치태 40종의 존재 유무를 checkerboard DNA-DNA hybridization 방법을 통해 분석하였고, 서로 밀접히 연관된 미생물 군들을 밝혀낸 바 있다17. 이 가운데 초기 집락군 이후에 점차 우세해 지며 후기 집락군과의 사이 가교 역할을 하는 orange complex와 후기 집락군인 red complex는 치주질환의 주된 원인인자로 연구된 바 있다17. 건강한 치주조직의 안정적인 임플란트는 건강한 치주를 지닌 자연치 주변과 마찬가지로 주로 구균(cocci)에 의해 집락화되어 있으며, 방추상균(fusiforms), 운동성 간균(motile bacilli), 나선형 세균(spirochetes)은 거의 검출되지 않았으나, 임플란트 주위염 병소 주위의 세균총에서는 구균은 훨씬 적은 비율로 나타났고, 방추상균, 운동성 간균, 나선형 세균이 매우 높은 수준으로 나타났다18. 자연치의 치은염이 치주염으로 이행되는 기전과 마찬가지로 임플란트 주위 점막염도 임플란트 주위염으로 전환되면서 낭이 깊어짐에 따라 호기성 균들보다 혐기성, 그람 음성, 운동성 균종의 비중이 커지는 것이 배양 기법을 통하여 증명되었다19. Shibli 등은 44명을 대상으로 최소 2년 이상 기능한 임플란트 수복물에 대하여 건강한 임플란트와 임플란트 주위염이 있는 임플란트의 치태세균을 조사한 결과, 임플란트 주위염이 있는 임플란트 주변에서 점막 연상, 연하 모두 red complex (Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola)가 대조군에 비하여 그 비율이 상당히 높았고, 유익종으로 여겨지는 purple (Veillonella parvula 등), yellow (Streptococcus sanguinis 등), green complex는 점막 연상에서 비슷했으나 연하에서는 질환군이 더 낮게 나타났다고 보고하였다20. 다른 checkerboard DNA-DNA hybridization을 이용한 연구에서 임플란트 주위염 부위, 임플란트 주위염이 있는 환자의 안정적 임플란트 부위 및 자연치, 임플란트 주위염이 없는 환자의 안정적 임플란트 부위 및 자연치에서 12종의 미생물 수준을 평가한 결과, P. gingivalis, P. intermedia, T. forsythia, Aggregatibacter actinomycetemcomitans, T. denticola와 같은 치주 병원균들이 임플란트 주위염을 지닌 환자에게서 106 이상 높은 수준으로 검출되었다21. 이와 같이 여러 연구에서 치주염과 임플란트 주위염 관련 미생물 균종들은 다수의 교집합을 보이고 있고(Table 1)22, 치주염의 주요 원인균들이 임플란트 주위염의 주요 원인균으로도 작용하고 있는 것으로 밝혀졌다23,24. 그러나, 임플란트와 자연치 사이의 미생물 분포의 차이점도 보고되고 있다. 임플란트 주변, 특히 임플란트 주위염이 존재하는 부위에서 Staphylococcus aureus가 더 높은 수준으로 검출되었다는 점이며25, 이 외에도 Pseudomonas aeruginosa, enteric rods, yeast에 속하는 Candida albicans와 같이 치주질환과 연관 없는 다른 미생물들이 임플란트 주위 병소에서 종종 관찰되고 있다23,26. 배양 기반 미생물 검사 방법의 검체의 양의 한계, 검사의 낮은 민감도와 특이도, 교차 반응의 오류 등이 16S rRNA 유전자 클론 라이브러리 분석법(gene clone library analysis)나 16S pyrosequencing과 같은 최신 기법을 통하여 획기적으로 개선됨에 따라 임플란트 주위염 연관 미생물총에서 치주염 관련 미생물과 무관한, 과거에 밝혀지지 않았던 새로운 균종도 발견되고 있는 것이다27,28. 실제로 Next-Generation Sequencing (NGS) 기술로부터 사람의 구강에 19,000여 종류의 매우 다양한 미생물 계통형(phylotype)이 존재한다는 것이 밝혀진 바 있으며29-31, 이는 전통적 기법들을 통한 연구에서 보고된 700에서 1000종류와는 비교 할 수 없는 다양성을 보이고 있다. 그러나 아직 임플란트 주위염 연관 세균총 분석에 최신 기법을 이용한 연구는 치주염 연관 연구보다 상대적으로 적은 편이다.
Table 1. Comparison of bacterial species related with chronic periodont itis and peri-implantitis22
V. 고찰 및 결론
임플란트 주위 질환은 일반적인 감염병과는 달리, 특정한 균의 존재만으로 질환의 임상증상이 나타나는 단순한 감염 질환이 아니라, 치주질환과 많은 교집합을 지닌 다수의 병원균, 숙주의 면역 및 염증반응의 정도, 후천적 환경요인 등이 복합적으로 작용하여 발생하는 질환이다. 실제로 임플란트 주위 질환의 발생에 있어서 미생물학적 원인은 치주염의 발생과 진행에 미치는 미생물의 영향과 그 과정 및 기전이 매우 공통점을 지니고 있으나, 임플란트 표면이 치아 표면과는 다른 토포그래피(topography)를 지니고 있고, 임플란트 주위 조직도 치주조직과 다른 특유의 면역학적 특성 및 조직 반응의 차이가 분명히 존재할 것이므로 치주염 연관 세균 분포와 비교 시, 유사한 가운데 차이점이 존재할 수 있으므로 주의 깊게 접근하여야 한다. 병소 부위에서 높은 역가의 미생물의 검출이 곧 질환의 진행이나 심도와 일치하는 것이 아니라는 점, 다수의 미생물이 포함되어 있어 특정한 균종의 동정만으로 질환에 관한 명백한 진단을 내릴 수 없다는 점, 검사를 할 부위를 정하기가 어려운 점, 특수한 실험실로 보내야만 하거나 시간적으로나 비용적으로 비효율적인 점 등 미생물학적 접근법은 그 한계점이 다수 존재한다. 그러나 미생물학적 원인이 임플란트 주위 질환의 주된 원인 요소 중 하나임이 명백하므로 질환과 연관된 미생물로 알려진 균종들이 높은 비율로 나타나는 개개인 혹은 부위에 있어 임상가들은 치료 개입을 결정할 때 그렇지 않은 경우보다 차별화가 필요할 것으로 사료된다.
실제로 최근 몇 회사에서1) 치주질환 병원균 및 임플란트 주위염 연관종으로 여겨지는 P. gingivalis, P. intermedia, T. forsythia, A. actinomycetemcomitans, T. denticola와 같은 균종을 포함하여 구강 내 세균의 분포를 분석하는 시스템을 구축해 가고 있다. 이러한 균종들이 높은 비율로 검출되는 환자들에게는 향후 임플란트 주위 질환의 예방을 위하여, 임플란트 치료 전 철저한 구강위생 행위의 교육 및 잔존치에 존재하는 치주질환의 치료가 필수적이다. 아울러 임플란트 치료 후에도 3개월 이내의 짧은 치주 유지치료(supportive periodontal therapy; SPT) 간격으로 질환에 관여하는 미생물 균종의 영향을 최소화하려는 노력이 임상가 및 환자 모두에게 요구된다. 만일 임플란트 주위염이 이미 진행된 경우라면 오염된 임플란트 표면의 철저한 세척과 함께 아목시실린(amoxicillin)과 메트로니다졸(metronidazole) 항생제 병용 요법을 동시에 시행하는 것이 추천된다32. 주의할 것은 항생제 요법만으로는 임플란트 주위염이 성공적으로 치료가 될 수 없으므로 대개 수술적인 접근을 통하여 충분하게 오염제거(decontamination)를 수행함과 동시에 항생제 요법은 보조적 치료로 시행하는 것이 바람직하다32.
현재까지 정립되어 있는 임플란트 주위 질환의 여러 원인 요소 이외에도 아직 명백히 밝혀지지 않은 많은 요소들이 향후 임상가들과 연구자들의 깊은 관심과 연구를 통하여 더 밝혀져야 할 것이다. 아울러 임플란트 주위 질환의 요인 중 커다란 비중을 차지하는 것으로 여겨지는 미생물학적 요인 또한, 전통적 검사 방식과 최신 기술을 잘 조합한 체계적이고 총괄적인 접근 방법과 잘 디자인된 임상연구를 통하여, 이러한 미생물들이 질환의 발생과 진행, 심도 및 개인의 반응 차이 등 여러 사안에 미치는 역할이 무엇인지 명백히 밝혀낼 수 있도록 부단한 노력이 필요할 것이다.
1)이지페리오, 와이디생명과학, 대한민국; 페리오젠, 마이크로이즈 바이오사업부, 대한민국




